Forschung
Geweberegeneration
Der menschliche Körper ist in der Lage, Weich- (z. B. Haut und Bindegewebe) und Hartgewebe (z. B. Knochen und Knorpel) nach verletzungs- und erkrankungsbedingten Schäden bis zu einem gewissen Maß zu erneuern. Dabei nimmt die Fähigkeit zur Regeneration mit zunehmendem Alter ab. Zusätzlich ist die Regenerationskapazität großflächiger Gewebedefekte, welche durch Tumorerkrankungen, Traumata, Infektionen, diabetische Komplikationen, chronische Entzündungen oder chirurgische Eingriffe entstehen können, limitiert. Das fehlende Gewebe muss mit alternativen Strukturen ersetzt werden, welche idealerweise dessen Form und Funktionalität übernehmen. Hierzu werden verschiedene Implantate auf Basis nicht-biologischer Materialien wie beispielsweise Metalle oder keramische Werkstoffe verwendet. Da das Immunsystem in der Lage ist, diese Materialien als fremd zu erkennen und durch Entzündungs- und Immunreaktionen zu inaktivieren, beziehungsweise abzustoßen (Jacob & Amudha, 2017), sind die Biokompatibilität und immunologische Verträglichkeit der Ersatzmaterialien von zentraler Bedeutung für die klinische Anwendung. Folgen einer unzureichenden Geweberegeneration und -integration sind für den Patienten neben wiederholten Klinikaufenthalten insbesondere die funktionellen Beeinträchtigungen aufgrund eingeschränkter Beweglichkeit und reduzierter Lebensqualität. Derzeit ist der autologe (körpereigene) Gewebeersatz der „Goldstandard“, da das Transplantat sowohl strukturell, funktionell als auch immunologisch mit dem Ursprungsgewebe in der Defektsituation übereinstimmt. Dieser Behandlungsansatz ist jedoch mit Belastungen für den Patienten verbunden, da umfangreiche operative Maßnahmen, wie die Entnahme des Transplantatgewebes an einer anderen Körperstelle nötig sind und zudem die Verfügbarkeit limitiert ist. Daher gewinnt der allogene (körperfremde, von der gleichen Spezies stammende) Gewebeersatz zunehmend an Bedeutung. Dieser ist für den Patienten vorteilhaft, da die operationsbedingten Risiken durch die Entnahme entfallen. Somit kann der allogene Gewebeersatz einen wesentlichen Beitrag zur Verbesserung der Lebensqualität, zur Rückkehr in ein aktives Leben und zur sozialen Integration leisten.
Knochenersatzmaterial in der Mund-, Kiefer- und Gesichtschirurgie
Der adäquate Gewebeersatz bei knöchernen Defekten stellt in der regenerativen Mund-, Kiefer- und Gesichtschirurgie eine nicht unerhebliche klinische Herausforderung dar. So ist der Patientenwunsch nach festsitzendem Zahnersatz bei teil- oder gar unbezahnten Patienten häufig nur unter Verwendung von implantatgetragenen oder -gestützte Prothesen möglich, da konventionelle Konzepte die Erwartungen der Patienten oft nur bedingt oder gar nicht erfüllen können. Allerdings setzt selbst der Einsatz kurzer dentaler Implantate (Dau <em>et al</em>., 2017) ein suffizientes Knochenangebot voraus, das bei kraniofazialen Fehlbildungen, parodontalen Erkrankungen, Traumata, oder auch nach einer Tumortherapie nicht immer gegeben ist. Bislang ist der autologe Knochen die bewährteste und beste Therapie, da er alle Eigenschaften eines optimalen Materials besitzt. Vorteilhaft ist das Ausbleiben einer immunologischen Reaktion. Die Entnahme, sei sie von intra- oder extraoral, bedingt jedoch immer eine verlängerte Operationsdauer sowie eine Morbidität an der Entnahmestelle. Auch andere Gewebeersatzmaterialien, wie xenogene (körperfremde (von einer anderen Spezies)) oder alloplastische (künstliche) Knochenersatzmaterialien weisen zum Teil deutliche Unterschiede sowohl bezüglich der mechanischen und biologischen als auch der immunologischen Eigenschaften gegenüber autologem Knochen auf. Nichtsdestotrotz bestehen derzeit bei Verwendung des allogenen Knochens in der regenerativen Mund-, Kiefer- und Gesichtschirurgie ausgeprägte Ressentiments hinsichtlich der potentiellen allergenen und infektiösen Eigenschaften, weshalb der patienteneigene Knochen trotz der Entnahmemorbidität zumeist bevorzugt wird. Daher wäre es von großem Vorteil, verbesserte aufgereinigte allogene Transplantate bei unveränderter Knochenstruktur und mit identischen mechanischen Eigenschaften anbieten zu können.
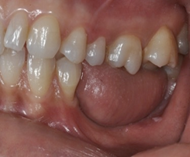
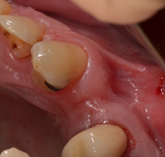
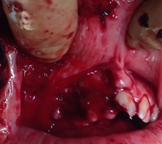
Knorpelersatz in der Hals-, Nasen und Ohrenheilkunde
In der anatomisch komplexen Kopf-Hals-Region führen Verletzungen, Fehlbildungen und Tumore häufig zu funktionellen und psychosozialen Einschränkungen. Die entstandenen Defekte werden üblicherweise mit Knorpel- und Faszientransplantaten rekonstruiert. Während Knorpel häufig in der Nasen-, Ohr-, Tracheal- und plastischen Gesichtschirurgie eingesetzt wird, hat sich Faszie, trotz der ständigen Weiterentwicklung von synthetischen Biomaterialien, als verlässlichstes Material zum Verschluss von Schädelbasisdefekten etabliert.
Autologer Knorpel aus Ohrmuschel, Nasenseptum oder Rippenknorpel wird als hervorragendes Transplantat zur Rekonstruktion, Defektdeckung und Augmentation in der Nasen-, Ohr-, Tracheal-, und plastischen Gesichtschirurgie eingesetzt (Liu et al., 2017; Firat et al., 2011). Bei großen Defekten oder bei der Notwendigkeit, eine Co-Morbidität an der Entnahmestelle zu vermeiden, ist jedoch der autologe Knorpel nicht ausreichend. Für diese Fälle wird allogener, xenogener oder synthetischer Knorpel mit guten biomechanischen Eigenschaften, natürlicher Form und hervorragender Biokompatibilität dringend benötigt (Arzi et al., 2015). Bekannte allogene Knorpelgrafts wie „Juvenile Particulated Cartilage“, die für Indikationen in der orthopädischen Chirurgie bereits in klinischen Studien getestet werden, sind für den Einsatz in Kopf-Hals-Chirurgie aufgrund ihrer Immunogenität und Form nicht geeignet (Fujihara et al., 2010). Die hydrostatische Hochdrucktechnologie könnte bei der Herstellung von Knorpelallografts eine wichtige Rolle spielen, da die vergleichsweise kurzzeitige und schonende Prozessierung einen erheblichen Vorteil gegenüber konventionellen Dezellularisierungsmethoden hinsichtlich der Matrixintegrität aufweist.

Faszientransplantate in der Hals-, Nasen- und Ohrenheilkunde
Auto- und Allografts aus Fasziengewebe zählen trotz der Entwicklung von Kollagenmatrizes und anderer Biomaterialen zu den verlässlichsten Transplantaten bei der Rekonstruktion zweidimensionaler Gewebedefekte und werden vor allem in der Kopf-Hals-Chirurgie verwendet (Tarhan et al., 2008). Die häufig transplantierte Fascia lata kann hierfür durch einen zusätzlichen Eingriff entnommen werden. Dies führt zu verlängerten Operationszeiten, zusätzlichen Komplikationen und einer schmerzbedingt verlangsamten postoperativen Mobilisierung, die auch der zunehmenden Ambulantisierung von Eingriffen im Kopf-Hals-Bereich entgegensteht. So werden für die Entnahme von Fascia lata neben allgemeinen OP-Risiken auch bleibende Schäden und Schmerzen durch Herniation des Muskels beschrieben (Kashkouli et al., 2007). Die Transplantation von gut kompatiblen Allografts hingegen kann die Operationsdauer und postoperative Morbidität deutlich verringern. Neben dem Erhalt der mechanischen Eigenschaften ist für die Biokompatibilität des Allografts eine weitgehende Eliminierung der Spenderantigene erforderlich. Eine vollständige Entfernung der Spender-HLA-Antigene aus Fascia lata konnte mit etablierten Methoden bisher nicht erreicht werden (Fitzgerald et al., 2000). Ausreichende Untersuchungen zur Reduzierung der Immunogenität von Faszie durch Hochdruckbehandlung liegen derzeit nicht vor und sind somit Gegenstand dieses Forschungsprojektes.


